13816115175
稳转株构建是一种生物学技术,旨在创建能够在细胞中稳定表达外源DNA的细胞株。这通常涉及将目的基因或shRNA克隆到带有特定抗性标记的载体上,然后将这个重组载体转染到宿主细胞中,并整合到宿主细胞的基因组中。随后,通过药物筛选等方法,选择出能够稳定传递外源DNA的细胞株。
一、稳转株构建常用方法
(1)质粒直接转染。使用脂质体等试剂将质粒DNA转染到细胞中,然后通过抗生素筛选等方法筛选出稳定整合了外源DNA的细胞株。
(2)慢病毒侵染。利用慢病毒载体将目的基因或shRNA转染到细胞中,慢病毒载体能将DNA整合到细胞基因组中,从而实现稳定表达。这种方法适用于各种类型的细胞,且整合效率高。
二、稳转株构建流程
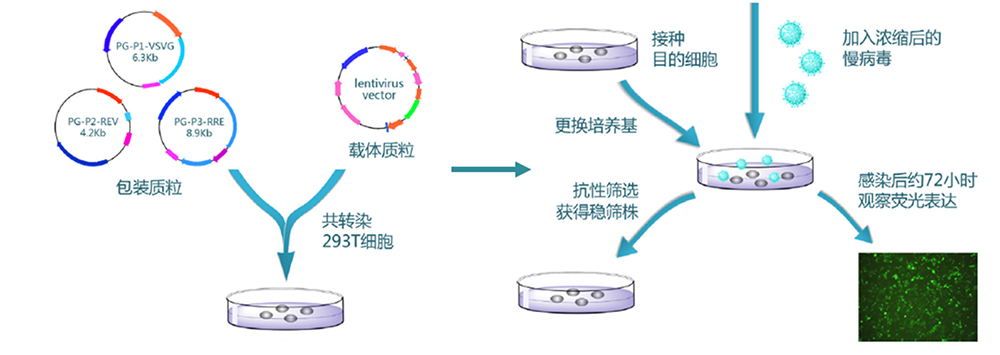
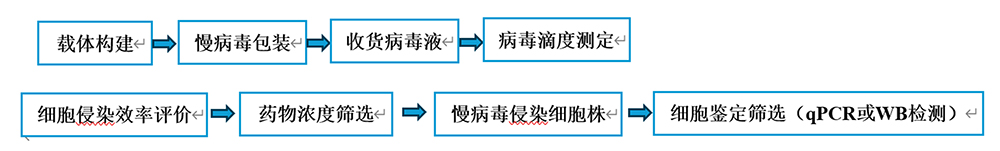
三、稳转株筛选实验方法
(1)侵染效率评价
侵染效率是指成功侵染的细胞数与总细胞数的比例。可以通过显微镜观察侵染后的细胞数量来计算转染率。利用带荧光的NC对细胞进行侵染,正常18-24小时换液,侵染3天后荧光显微镜观察拍照(荧光+明场细胞图片)
(2)最小致死浓度筛选
确定抗生素作用的最佳浓度:不同的细胞株对各种抗生素有不同的敏感性,因此在筛选前要做预试验,确定抗生素对所选择细胞的最低作用浓度。
③ 培养 3-7天以绝大部分细胞死亡浓度为准,一般为 1μg/ml(以嘌呤霉素为例),筛选稳定表达克隆时可比该浓度适当提高一个级别维持时使用筛选浓度的一半。
(3)稳转株筛选正式实验
按照侵染效率评价70%以上阳性的病毒用量进行侵染,侵染48h-72h可以先观察荧光,侵染72h收取瞬时侵染样进行WB或QPCR检测,按照最小致死的浓度开始加药筛选,正常筛选1-2周,荧光全亮且WB或QPCR检测正常即为稳转株。